2020年10月28日,来自美国德克萨斯州西南大学和中国武汉大学模式动物研究所的研究人员,合作在Circulation上发表了题为Epigenetic Reader BRD4 Governs Nucleus-encoded Mitochondrial Transcriptome to Regulate Cardiac Function的研究性文章,首次报道了BRD4在调节心肌细胞线粒体稳态上的作用,观察到BRD4的功能对于维持正常的心脏功能是必不可少的。这项研究结果对临床有巨大的指导意义,因为目前为治疗肿瘤和其他疾病,开发出越来越多的靶向BRD4的强效和特异性抑制剂,因此必须仔细监测病人基础心脏功能以及线粒体恶化情况。

研究背景
BET(Bromodomain和Extra-Terminal)表观遗传阅读蛋白,尤其是BRD4,已成为许多病理状况(包括癌症和心血管疾病)中潜在的治疗靶点。小分子BET蛋白抑制剂(如JQ1)在临床前模型中已被证明可逆转心肌肥厚和心力衰竭。然而,目前仍未阐明BET蛋白在心脏中的生物特性,以验证药理学发现,并揭示潜在的药理学副作用。
研究方法
1)动物研究:工具鼠—心脏特异性BRD4敲除小鼠(高分文章必备);动物模型—主动脉缩窄术,心肌肥厚以及心力衰竭模型(TAC,最经典的心脏病模型之一,对手术要求极高,非常考验手法)
2)RNA测序:(目前最火的研究手段,文章立刻上了一个档次)大致做法:心脏取材,速冻左心室进行RNA提取。将RIN>8的样品交给公司进行文库制备和下一代测序(拿到数据最快最便捷的方法)。简单介绍一下RNA测序具体做法,使用具有poly-A富集的NEB文库试剂盒制备cDNA文库。通过NovaSeq6000对纯化的cDNA文库进行测序,每个样品>30M原始读数(150bp,配对)。分析RNA-seq数据集的差异表达,GO,GSEA,基因模块和潜在转录因子。
3)线粒体酶活性:(最经典的线粒体研究方法之一)首先要分离心室肌中的线粒体(一定要保证新鲜)。使用动力学模式下的比色皿在室温下,对完整的或超声处理的线粒体进行酶分析,其中的酶包括NAD相关的电子传递链复合体I, III, IV,TCA循环酶活性。
4)线粒体呼吸测定:氧气消耗率OCR(做线粒体一定要知道的重要指标),它的原理是这样的,线粒体通过克氏循环 (Kreb cycle) 分解脂肪酸及丙酮酸,随后通过电子传递链产生大量的ATP作为细胞的能量来源,这个过程会消耗氧作为电子传递链的最终接受者,因此OCR说明有氧代谢的速率。
研究结果
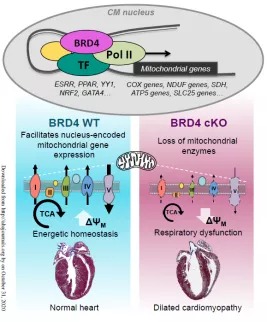
1)表型—心肌细胞特异性BRD4敲除导致收缩功能障碍和扩张型心肌病
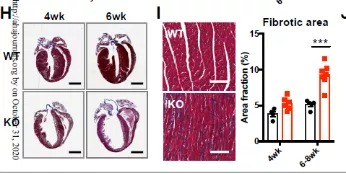
首先,做实验的常规套路,就是拿到工具鼠之后,先检测一下它的表型。研究者发现心肌细胞BRD4敲除(cKO)小鼠随着年龄表现出进行性收缩功能障碍。cKO小鼠的缩短分数(衡量心室收缩力的指标)在测试的最早时间点(2周)略有下降,并随着时间逐渐下降。这些小鼠也表现出肺水肿(心力衰竭的迹象)和死亡率增加:6周时死亡率为50%,到10周龄时死亡率接近100%。左心室的组织学分析显示心室明显变薄和间质纤维化。更加明显的现象是,与野生型小鼠相比,左心室质量和心重/胫骨长度在较晚的时间点(6-8周)显著增加,横截面积没有增加的迹象,表明没有向心肥大性生长。cKO心脏表现出偏心性重塑。(总之,就是BRD4在心脏上一被敲除,就出现了明显的表型,多么幸运!)
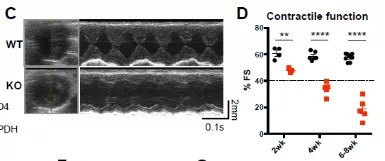
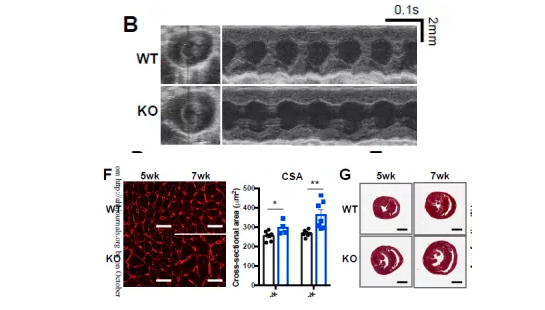
2)表型—成年心脏BRD4缺失引起收缩功能障碍和心力衰竭
接下来,在另一种类型的工具鼠上进一步确定表型。研究者利用成熟的成年小鼠心脏,即8周大的cKO系小鼠,给予他莫昔芬注射2周后,在心脏上特异性敲除了BRD4。观察到成年cKO小鼠的心脏保持正常的收缩功能,直到注射后3周,出现了与αMHC-CrecKO小鼠类似的表型,随后发展为进行性收缩功能不全和室扩张,并伴有心力衰竭和死亡率增加的迹象。与产后cKO相比,成年的BRD4敲除心脏并未发生明显的纤维化,但表现出组织肥厚。(总之,在两个BRD4 cKO模型上的发现,提示BRD4是维持出生后和成年期心肌收缩功能所必需的。)
3)机制—转录组分析揭示基因变化图谱
既然这么明显的表型已经确定了,接下来就该寻找BRD4缺失后导致心肌功能障碍的机制了,我们一起来看看是怎样做的。
研究者对BRD4敲除心脏的早期转录组学变化进行了全面的RNA序列分析。为了最大程度地减少由于心力衰竭表型引起的继发性变化的影响,利用了成年诱导型BRD4 cKO小鼠,在明显的心脏表型出现之前进行了研究。
为了寻找潜在的BRD4基因敲除和药理性抑制之间的表型差异的机制,研究者使用经JQ1(小分子BET蛋白抑制剂)处理的心脏作为比较组,共分为三组:从WT,cKO和JQ1处理的小鼠,取左心室评估了富含poly A的转录组,含有3,000多个差异表达的基因。对数据进行分析显示,cKO和JQ1处理组显示出了共有的和不同的基因集。
为了进一步剖析差异基因的表达,进行模块分析以鉴定基因亚群。总共鉴定出16个基因模块,其中前5个显示出明显的富集得分,其中线粒体基因通路发生明显变化。(总之,通过RNA-seq的发现,详细比较了药理BET蛋白抑制与BRD4基因敲除对转录组的影响。BET蛋白抑制导致心脏转录丰度发生广泛变化,而特异性破坏BRD4,包括敲除和抑制,都会导致核编码的线粒体基因发生早期且显著的变化)
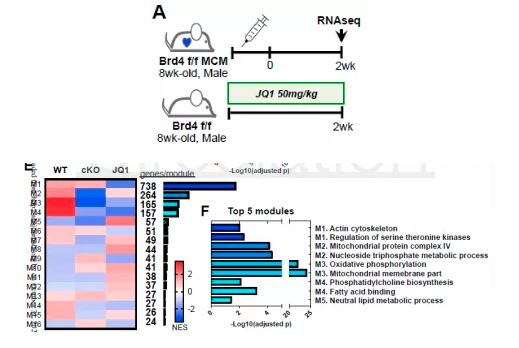
4)机制—BRD4调节核编码的线粒体基因表达
为了进一步研究BRD4依赖的线粒体调控,研究者分离了cKO组特有的基因组进行深度分析,发现下调的基因比上调的基因多两倍。cKO组中变化的最重要途径是调节ATP合成和氧化磷酸化的线粒体电子传递链基因。
此外,研究者发现钙/兴奋收缩偶联途径得基因显著下调,以及心肌重塑基因的上调。在左心室和分离的成年小鼠心室肌细胞样品中RNA序列鉴定的转录物变化,在早期和晚期,以及两个Cre系中,均通过qPCR验证。代谢物网络分析显示,cKO中下调基因的与NADH,氧气和氧化还原敏感的代谢物高度一致,进一步证实了心肌细胞BRD4主要参与驱动线粒体电子传递链相关基因。(数据分析中找到了机制,所以拿到手的数据一定要好好把握)
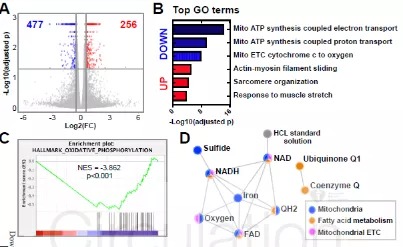
5)机制—BRD4驱动电子传递链蛋白表达调控线粒体稳态
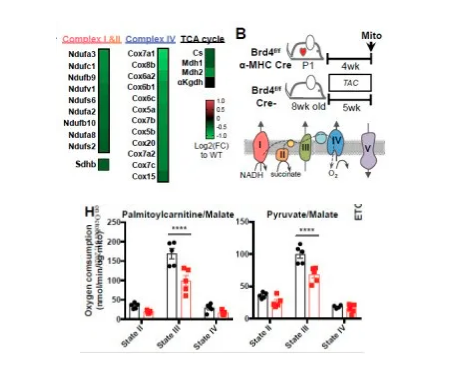
既然BRD4驱动了转录变化,那么心脏电子传递链的功能是否发生改变?研究者对每种线粒体电子传递链复合物进行了酶活性测定,分离了四组心脏:WT组,出现心功能障碍的cKO组,以及sham,TAC组(作为对照,以区分BRD4驱动的改变和心衰驱动的改变)。
结果显示cKO组的各项指标—每个线粒体的电子传递链活性、最大的NADH氧化速率测得的总质子泵容量(复合物I,III,IV)、单独测量的每种复合物(复合物I,III,IV)均证实了电子传递链活性降低。相比之下,TAC诱发的衰竭心脏中分离出的每个线粒体均具有完整的电子传递链功能,这表明cKO中电子传递链活性的降低是一种与心力衰竭无关的表型。
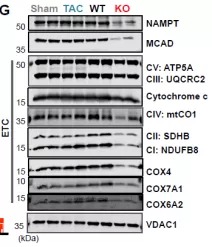
除了电子传递链复合物,在cKO心脏中下调的TCA循环酶表现出每个线粒体活性降低。免疫印迹显示线粒体酶(包括电子传递以及其他代谢过程中的酶)明显减少,这与转录物的变化一致。
为了检测酶活性的变化是否影响线粒体OXPHOS的能力,研究者在不同代谢底物下,测量了线粒体O2的消耗量。来自cKO心肌的线粒体利用脂肪酸和丙酮酸产生能量的能力下降。(总之,这些发现提示心肌细胞BRD4转录调节关键的线粒体电子传递链和TCA循环酶的表达,以维持心肌的能量稳态)
6)机制—确定调控BRD4的转录因子
最后,逻辑是这样的,上述都是BRD4的下游作用,即对线粒体基因网络的转录调控,那么BRD4上游是怎样的,最有可能就通过转录因子实现对BRD4的调控,所以研究者探索了可能的转录因子。基于染色质相互作用或转录因子扰动研究,针对多个转录因子数据库查询cKO调控的基因列表。将来自四个数据库的“热点转录因子”汇合在一起,总共产生了13个转录因子组,其中只有一个转录因子家族,ESRR(雌激素相关受体)出现在所有数据库中。
研究者检测了排名最高的转录因子—ESRRα是否参与BRD4介导的线粒体基因调控。在许多cKO下调的线粒体基因(如Mcad和Sdhb)的启动子区域定位了ESRRα结合基序,并通过ChIP-qPCR进行了验证:1)BRD4结合带有ESRRα的区域,且在BRD4 cKO中有明显的置换;2)BRD4缺失情况下,ESRRα从每个启动子的含ERRE的区域被置换。(最最经典的上游调控机制,转录因子必不可少)
总结
创新点:这项研究揭示了BRD4蛋白在维持心肌收缩功能和线粒体内稳态中的重要作用。利用心肌细胞特异性BRD4敲除模型,发现BRD4调节心肌中线粒体基因的表达。BRD4基因缺失会导致关键的核编码线粒体基因,以及参与兴奋收缩偶联基因的表达急剧下调。这些变化导致心肌细胞中缺乏参与线粒体电子传递链和代谢物循环(三羧酸循环和脂质氧化)的关键酶。结果是心室收缩功能,心室扩张和心肌病逐渐下降。最后证明了BRD4在维持正常心肌细胞生理上的作用,之前的报道表明BRD4在促进病理性心脏重塑中的作用,但是这项研究结果与之完全相反。
局限性:首先,转录组学分析和ChIP-qPCR实验无法描述染色质的变化。需要使用染色质图谱技术(例如ATAC-Seq或H3K27ac ChIP-Seq)来检测启动子和增强子占用率的变化,并探索心脏中BRD4的其他潜在转录分子。其次,这项研究采用的酶法测定的是每种复合物的最大容量,而不是生理条件下的活性,需要通过代谢物分析或放射性脉搏追踪进行研究,以评估完整心脏的代谢变化。
心脏方面未来研究热点:Circulation是心血管领域Top1的顶级期刊,IF=23.603 (2019),它上面的很多文章都是经典文章。对于做心血管研究的,小编强力推荐学习这上面的文章。今天我们分享的是一篇基础研究型的文章,可以看到它的研究从上游—分子(表型)—下游,面面俱到,工作量巨大。当然,这也是斩获高分文章“杀手锏”。由于心脏组织结构的特殊性,线粒体相关研究一直是心脏研究的“明星”领域,未来相关研究仍会继续深入。此外,也会更多地关注心脏在生理及病理条件下的代谢分析或变化,朝着更精准化发展。